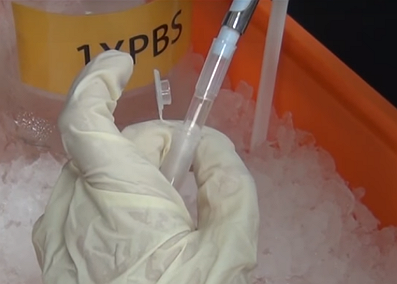
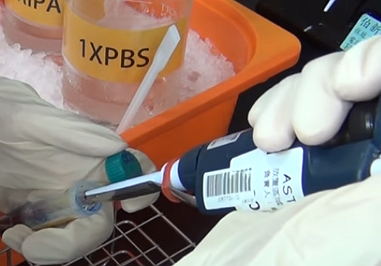
蛋白質的萃取
-
00:00
1.
Western Blot - Sample preparation [Video from GeneTex]
播放影片: http://lab.formosasoft.com/media/139
重點
- 2.定量蛋白質含量此上清液(含蛋白質),以 modified Bradford method 定量蛋白質含量(以 Bio-Tek Elx800 分析吸光值,來測定各標本之蛋白質量)。
- Tricine Sodium Dodecyl Sulfate(SDS)膠體之準備
- 5.配置10﹪的分離膠體(separation gel for COX-2)將30﹪Acrylamide solution 5ml,3M pH8.45 Tris –HCl 5ml,40﹪glycerol 5ml,10﹪Ammonium persulfate 75μl及TEMED 7.5μl混合均勻後;立即注入注膠器之玻璃板間,並於其上層注入100﹪酒精,使其表面平整,靜置至膠體硬化後,再將上層酒精倒出吸乾。
- (僅模擬資料,資料來源: http://p5a2u2l6.pixnet.net/blog/post/30322139)
檢核清單
- 位置
-
- 資料夾名稱
- western blot (西方點漬法)
- 上傳者
- 系統管理者
- 單位
- 台灣數位學習科技
- 建立
- 2018-12-18 09:43:28
- 最近修訂
- 2018-12-19 07:14:35
- 長度
- 02:34
- 引用
- 1
- 來源
- https://www.youtube.com/watch?v=WDqGQaV7Q60&index=2&list=PL9MMxtqzXYVLy74oC1BiAIiRuNLDCd43u